Guidelines ADA 2022 của Hiệp hội Đái tháo đường Hoa Kỳ về Tiếp cận cách dùng thuốc trong điều trị đái tháo đường – Pharmacologic Approaches to Glycemic Treatment.
Điều trị đái tháo đường type 1
Khuyến cáo của ADA trong điều trị đái tháo đường type 1
Hầu hết bệnh nhân Đái tháo đường type 1 nên được điều trị bằng cách tiêm insulin nhiều mũi: insulin nền và trước các bữa ăn, hoặc truyền insulin dưới da liên tục. A
Hầu hết bệnh nhân Đái tháo đường type 1 nên sử dụng insulin tác dụng nhanh analog để giảm nguy cơ hạ đường huyết. A
Bệnh nhân Đái tháo đường type 1 nên được giáo dục về cách điều chỉnh liều insulin trong bữa ăn tùy thuộc vào lượng carbohydrate, hàm lượng chất béo và protein cũng như hoạt động thể chất dự kiến. B
Liệu pháp Insulin điều trị đái tháo đường type 1
Vì đặc trưng của bệnh đái tháo đường type 1 là chức năng tế bào beta hầu như không còn, nên việc điều trị bằng insulin là cần thiết.
Ngoài gây tăng đường huyết, thiếu hụt insulin còn góp phần gây ra các rối loạn chuyển hóa khác như tăng triglyceride máu và nhiễm toan ceton cũng như dị hóa mô có thể đe dọa tính mạng. Trong sáu, bảy thập niên từ sau khi insulin được phát hiện, tình trạng mất bù chuyển hóa nghiêm trọng có thể được ngăn ngừa bằng cách tiêm một hoặc hai lần insulin mỗi ngày. Tuy nhiên, trong ba thập kỷ gần đây, đã có nhiều bằng chứng ủng hộ liệu pháp điều trị insulin tích cực, bằng cách sử dụng nhiều lần tiêm insulin hàng ngày hoặc tiêm dưới da liên tục thông qua máy bơm insulin, mang lại sự kết hợp tốt nhất giữa hiệu quả và an toàn cho những người mắc bệnh đái tháo đường type 1.
Nghiên cứu Diabetes Control and Complications Trial (DCCT) đã chứng minh rằng liệu pháp điều trị insulin tích cực với nhiều mũi tiêm hàng ngày hoặc truyền insulin dưới da liên tục (CSII) làm giảm A1C và cải thiện các biến chứng lâu dài (1-3).
Nghiên cứu được thực hiện với human insulin tác dụng ngắn (regular) và trung bình (NPH). Trong thử nghiệm mang tính bước ngoặt này, A1C thấp hơn với kiểm soát tích cực (7%) dẫn đến giảm 50% các biến chứng mạch máu nhỏ trong 6 năm điều trị. Tuy nhiên, liệu pháp điều trị insulin tích cực có liên quan đến tỷ lệ hạ đường huyết nghiêm trọng cao hơn so với điều trị thông thường (62 so với 19 đợt trên 100 bệnh nhân-năm điều trị). Theo dõi các đối tượng từ nghiên cứu DCCT, sau hơn 10 năm cho thấy ít biến chứng mạch máu lớn cũng như mạch máu nhỏ hơn ở nhóm được điều trị tích cực (2,4).
Các phác đồ điều trị bằng insulin thường bao gồm insulin nền, insulin dùng trong bữa ăn và insulin hiệu chỉnh (5). Insulin nền bao gồm insulin NPH, insulin analog tác dụng kéo dài, và insulin tác dụng nhanh được bơm liên tục qua máy bơm insulin.
Insulin analog nền có thời gian tác dụng dài hơn, phẳng hơn và nồng độ trong huyết tương hằng định hơn so với insulin NPH; Các chất analog tác dụng nhanh (RAA) có thời gian khởi phát và đạt đỉnh nhanh hơn và thời gian tác dụng ngắn hơn so với human regular insulin. Ở những người mắc bệnh đái tháo đường type 1, điều trị bằng insulin analog có liên quan đến việc hạ đường huyết và tăng cân ít hơn cũng như giảm A1C so với human insulin (6–8). Gần đây hơn, hai công thức insulin tiêm mới với cấu hình tác dụng nhanh nâng cao đã được giới thiệu. Human insulin dạng hít đạt đỉnh nhanh chóng và thời gian tác dụng ngắn hơn so với RAA và có thể ít gây hạ đường huyết và tăng cân hơn (9) (xem thêm tiểu mục “Insulin dạng hít” trong LIỆU PHÁP DÙNG THUỐC CHO NGƯỜI LỚN MẮC ĐÁI THÁO ĐƯỜNG TYPE 2), đồng thời insulin aspart và insulin lisproaabc có thể làm giảm thay đổi glucose bữa ăn tốt hơn RAA (10–12). Ngoài ra, các analog nền mới có tác dụng lâu hơn (U-300 glargine hoặc degludec) có thể gây ra nguy cơ hạ đường huyết thấp hơn so với U-100 glargine ở những người mắc bệnh đái tháo đường type 1 (13,14). Cho dù có nhiều ưu điểm của insulin analog ở những người mắc bệnh đái tháo đường type 1, nhưng đối với một số người, chi phí và/hoặc cường độ điều trị cần thiết cho việc sử dụng chúng là quá khả năng. Có nhiều cách tiếp cận để điều trị insulin, và giới hạn trung tâm trong việc quản lý bệnh đái tháo đường type 1 là một số dạng insulin được cung cấp theo một chế độ kế hoạch phù hợp với cá nhân để giữ cho họ an toàn và không bị nhiễm toan ceton do đái tháo đường và tránh hạ đường huyết đáng kể, với mọi nỗ lực được thực hiện để đạt được mục tiêu đường huyết của cá nhân.
Hầu hết các nghiên cứu so sánh nhiều mũi tiêm hàng ngày với CSII đều tương đối nhỏ và có thời gian ngắn. Tuy nhiên, một nhận xét hệ thống gần đây và phân tích tổng hợp kết luận rằng CSII thông qua liệu pháp bơm có lợi ích khiêm tốn trong việc hạ A1C (0,30% [95% CI 0,58 đến 0,02]) và giảm tỷ lệ hạ đường huyết nghiêm trọng ở trẻ em và người lớn (15) . Tuy nhiên, không có sự đồng thuận để hướng dẫn lựa chọn liệu pháp tiêm hoặc bơm ở một cá nhân nhất định, và nghiên cứu để hướng dẫn việc ra quyết định này là cần thiết (16). Sự xuất hiện của máy theo dõi đường huyết liên tục (CGM) trong thực hành lâm sàng đã được chứng minh là có lợi ở những người sử dụng liệu pháp insulin. Việc sử dụng nó hiện được coi là tiêu chuẩn chăm sóc cho hầu hết những người mắc bệnh đái tháo đường type 1 (5) (xem Chương 7, “Công nghệ bệnh đái tháo đường”. phân phối insulin ở mức đường huyết đặt trước (16–18). Khi lựa chọn trong số các hệ thống phân phối insulin, cần cân nhắc sở thích của bệnh nhân, chi phí, loại insulin và chế độ dùng thuốc, và khả năng tự quản lý (xem Chương 7, “Công nghệ bệnh đái tháo đường”).
Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) hiện đã phê duyệt hai hệ thống bơm vòng kín hỗn hợp (còn được gọi là hệ thống phân phối insulin tự động [AID]). Tính an toàn và hiệu quả của hệ thống vòng kín lai đã được hỗ trợ trong tài liệu ở thanh thiếu niên và người lớn mắc bệnh đái tháo đường type 1 (19,20), và bằng chứng gần đây cho thấy hệ thống vòng kín ưu việt hơn liệu pháp bơm tăng cường cảm biến đường huyết trong kiểm soát và giảm tình trạng hạ đường huyết trên 3 tháng so sánh ở trẻ em và người lớn mắc bệnh đái tháo đường type 1 (21). Trong thử nghiệm vòng khép kín bệnh đái tháo đường quốc tế (iDCL), một thử nghiệm kéo dài 6 tháng ở những người mắc bệnh đái tháo đường type 1 ít nhất 14 tuổi, việc sử dụng hệ thống vòng kín có liên quan đến tỷ lệ phần trăm thời gian trong phạm vi đường huyết mục tiêu (%TIR) lớn hơn, giảm mức đường huyết và A1C trung bình, và tỷ lệ phần trăm thời gian bị hạ đường huyết thấp hơn so với sử dụng máy bơm cảm biến (22).
Quản lý insulin chuyên sâu bằng cách sử dụng CSII và máy theo dõi đường huyết liên tục nên được xem xét ở hầu hết những người mắc bệnh đái tháo đường type 1. Hệ thống AID có thể được xem xét ở những người mắc bệnh đái tháo đường type 1 có khả năng sử dụng thiết bị một cách an toàn (tự mình hoặc với người chăm sóc) để cải thiện thời gian trong phạm vi (TIR) và giảm A1C và tình trạng hạ đường huyết (22). Xem Chương 7, “Công nghệ dành cho bệnh đái tháo đường”, để thảo luận đầy đủ về các thiết bị phân phối insulin.
Nói chung, những người mắc bệnh đái tháo đường type 1 cần 50% lượng insulin hàng ngày ở dạng nền và 50% ở dạng thực phẩm, nhưng điều này phụ thuộc vào một số yếu tố, bao gồm cả việc người đó tiêu thụ các bữa ăn có hàm lượng carbohydrate thấp hơn hay cao hơn. Tổng nhu cầu insulin hàng ngày có thể được ước tính dựa trên cân nặng, với liều lượng điển hình là từ 0,4 đến 1,0 đơn vị/kg/ngày. Hàm lượng cao hơn được yêu cầu trong tuổi dậy thì, mang thai và bệnh tật. Hiệp hội Đái tháo đường Hoa Kỳ/Sách Nguồn về Bệnh đái tháo đường Type 1 của JDRF ghi nhận 0,5 đơn vị/kg/ngày là liều khởi đầu điển hình ở những người mắc bệnh đái tháo đường type 1 ổn định về mặt chuyển hóa, với một nửa được dùng dưới dạng insulin thường dùng để kiểm soát đường huyết sau bữa ăn và nửa còn lại như insulin nền để kiểm soát đường huyết trong khoảng thời gian giữa sự hấp thụ của bữa ăn (23); hướng dẫn này cung cấp thông tin chi tiết về việc tăng cường liệu pháp để đáp ứng nhu cầu cá nhân. Ngoài ra, tuyên bố quan điểm của Hiệp hội Đái tháo đường Hoa Kỳ (ADA) “Quản lý bệnh đái tháo đường týp 1 thông qua vòng đời” cung cấp một cái nhìn tổng quan sâu sắc về điều trị đái tháo đường týp 1 (24).
Các chế độ đa liều điển hình cho những người mắc bệnh đái tháo đường type 1 kết hợp việc sử dụng trước bữa ăn các chất insulin có tác dụng ngắn hơn với một công thức có tác dụng dài hơn. Liều cơ bản tác dụng kéo dài được chuẩn độ để điều chỉnh lượng glucose qua đêm, lúc đói. Các biến động glucose sau ăn được kiểm soát tốt nhất bằng cách tiêm insulin bữa ăn đúng thời gian. Thời gian tối ưu để sử dụng insulin bữa ăn thay đổi, dựa trên dược động học của công thức (regular, RAA, dạng hít), mức đường huyết trước khi ăn và mức tiêu thụ carbohydrate. Do đó, các khuyến cáo về việc sử dụng liều insulin regular nên được áp dụng cho từng cá nhân. Sự bài tiết insulin sinh lý thay đổi theo đường huyết, khẩu phần ăn, thành phần bữa ăn và nhu cầu về glucose của mô. Để tiếp cận sự thay đổi này ở những người sử dụng điều trị insulin, các chiến lược đã phát triển để điều chỉnh liều thực tế dựa trên nhu cầu dự đoán. Do đó, việc giáo dục bệnh nhân về cách điều chỉnh insulin bữa ăn để bao quát lượng carbohydrate, mức glucose trước khi ăn, và hoạt động dự đoán có thể có hiệu quả và nên được cung cấp cho hầu hết bệnh nhân (25,26). Đối với những cá nhân mà việc tính toán lượng carbohydrate hiệu quả, các ước tính về hàm lượng chất béo và protein trong bữa ăn có thể được kết hợp vào liều lượng thực tế của họ để bổ sung lợi ích (27) (xem Chương 5, “Tạo điều kiện thuận lợi cho Thay đổi Hành vi và Hạnh phúc để Cải thiện Kết quả Sức khỏe,”.
Báo cáo đồng thuận năm 2021 của ADA/Hiệp hội Châu u về Nghiên cứu Bệnh đái tháo đường (EASD) về việc quản lý bệnh đái tháo đường type 1 ở người lớn tóm tắt các chế độ insulin và chiến lược theo dõi glucose khác nhau ở những người mắc bệnh đái tháo đường type 1 (Hình 9.1 và Bảng 9.1) (5) .
Kỹ thuật tiêm insulin
Đảm bảo rằng bệnh nhân và/hoặc người chăm sóc hiểu đúng kỹ thuật tiêm insulin là điều quan trọng để tối ưu hóa việc kiểm soát đường huyết và an toàn khi sử dụng insulin. Do đó, điều quan trọng là insulin phải được đưa vào mô thích hợp theo cách chính xác. Các khuyến cáo đã được xuất bản ở những nơi khác nêu ra các phương pháp tiêm insulin tốt nhất (28). Kỹ thuật tiêm insulin thích hợp bao gồm tiêm vào các vùng cơ thể thích hợp, đổi xoay vòng vị trí tiêm, chăm sóc vị trí tiêm thích hợp để tránh nhiễm trùng hoặc các biến chứng khác, và tránh phân phối insulin trong cơ (IM).
Insulin được phân phối ngoại sinh nên được tiêm vào mô dưới da, không tiêm bắp. Các vị trí được đề xuất để tiêm insulin bao gồm bụng, đùi, mông và cánh tay trên. Vì sự hấp thụ insulin từ các vị trí IM khác nhau tùy theo hoạt động của cơ, việc tiêm IM vô ý có thể dẫn đến sự hấp thụ insulin không thể đoán trước và các tác động khác nhau lên glucose, trong đó tiêm IM có liên quan đến hạ đường huyết thường xuyên và không rõ nguyên nhân trong một số báo cáo. Nguy cơ đối với việc cung cấp insulin IM tăng lên ở những bệnh nhân trẻ hơn, gầy hơn khi tiêm vào các chi hơn là các vị trí trên than người (bụng và mông) và khi sử dụng kim dài hơn. Bằng chứng gần đây ủng hộ việc sử dụng kim ngắn (ví dụ, kim bút 4 mm) là hiệu quả và được dung nạp tốt khi so sánh với kim dài hơn, bao gồm một nghiên cứu được thực hiện ở người lớn bị béo phì (29).
Ngoài ra, việc xoay vòng vị trí tiêm là cần thiết để tránh loạn dưỡng mỡ, sự tích tụ mỡ dưới da để đáp ứng với các hoạt động tạo mỡ của insulin tại vị trí tiêm nhiều lần. Loạn dưỡng mỡ xuất hiện dưới dạng những vùng nổi lên mềm mại, mịn màng có chiều rộng vài cm và có thể góp phần vào việc hấp thụ insulin thất thường, tăng biến đổi đường huyết và các đợt hạ đường huyết không rõ nguyên nhân. Bệnh nhân và/hoặc người chăm sóc nên được giáo dục về cách xoay vòng vị trí tiêm thích hợp và cách nhận biết và tránh những vùng bị loạn dưỡng mỡ. Như đã nêu trong Bảng 4.1, kiểm tra các vị trí tiêm insulin để tìm sự hiện diện của chứng loạn dưỡng mỡ, cũng như đánh giá việc sử dụng thiết bị tiêm và kỹ thuật tiêm, là những thành phần quan trọng của một kế hoạch điều trị và đánh giá y tế toàn diện về bệnh đái tháo đường. Kỹ thuật tiêm insulin thích hợp có thể dẫn đến việc sử dụng liệu pháp này hiệu quả hơn và do đó, có khả năng cải thiện kết quả lâm sàng.
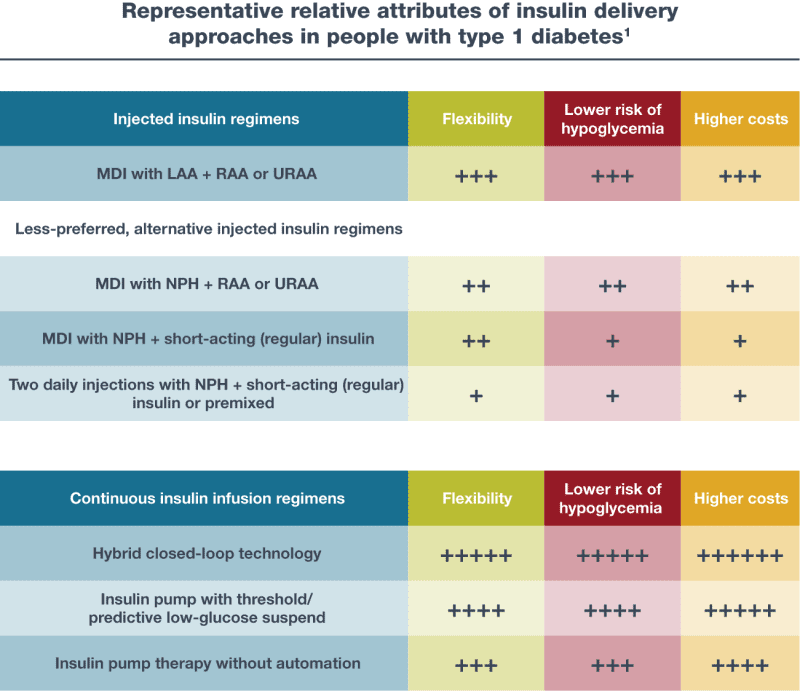
Máy theo dõi đường huyết liên tục (CGM) cải thiện kết quả với insulin tiêm hoặc truyền và ưu việt hơn so với máy theo dõi đường huyết thông thường (BGM). Insulin dạng hít có thể được sử dụng thay cho insulin bữa ăn dạng tiêm ở Hoa Kỳ. Số dấu cộng là ước tính về mối liên hệ tương đối của chế độ điều trị với việc tăng tính linh hoạt, nguy cơ hạ đường huyết thấp hơn và chi phí cao hơn giữa các phác đồ được xem xét. LAA, insulin analog tác dụng kéo dài; MDI, tiêm nhiều lần hàng ngày; RAA, insulin analog tác dụng nhanh; URAA, insulin analog tác dụng cực nhanh. Tái bản từ Holt et al. (5).
Bảng 9.1 Ví dụ về phác đồ insulin dưới da
Phác đồ bắt chước gần giống việc tiết insulin bình thường:
| Phác đồ | Thời gian và phân phối | Thuận lợi | Nhược điểm | Điều chỉnh liều lượng |
|---|---|---|---|---|
| Liệu pháp bơm insulin (vòng kín kết hợp, tạm ngưng glucose thấp, vòng mở tăng cường CGM, vòng mở tăng cường BGM) | Phân phối cơ bản của URAA hoặc RAA; nói chung là 40-60% TDD. Giờ ăn và hiệu chỉnh: URAA hoặc RAA bằng liều bolus dựa trên ICR và/hoặc ISF và đường mục tiêu, với insulin trước bữa ăn ∼15 phút trước khi ăn. | Có thể điều chỉnh tỷ lệ cơ bản để thay đổi độ nhạy insulin theo thời gian trong ngày, khi tập thể dục và cho những ngày ốm. Linh hoạt về thời gian và nội dung bữa ăn. Bơm có thể cung cấp insulin theo từng phần nhỏ của đơn vị. Tiềm năng tích hợp với CGM để đình chỉ glucose thấp hoặc vòng kín lai. TIR% cao nhất và TBR% thấp nhất với: vòng kín lai> tạm ngưng glucose thấp> Vòng hở tăng cường CGM> Vòng hở tăng cường BGM. | Phác đồ đắt tiền nhất. Phải liên tục đeo một hoặc nhiều thiết bị. Nguy cơ phát triển nhanh ketosis hoặc DKA với việc gián đoạn cung cấp insulin. Phản ứng tiềm ẩn với chất kết dính và nhiễm trùng trang web. Phương pháp tiếp cận phức tạp nhất về mặt kỹ thuật (khó hơn đối với những người có kỹ năng đọc hoặc viết kém hơn). | Insulin giờ ăn: nếu việc đếm carbohydrate là chính xác, hãy thay đổi ICR nếu glucose sau bữa ăn luôn nằm ngoài mục tiêu. Insulin hiệu chỉnh: điều chỉnh ISF và/hoặc đường đích nếu việc hiệu chỉnh không đưa đường huyết vào phạm vi một cách nhất quán. Tỷ lệ cơ bản: điều chỉnh dựa trên lượng đường qua đêm, lúc đói hoặc ban ngày ngoài hoạt động của URAA / RAA bolus. |
| MDI: LAA + liều linh hoạt của URAA hoặc RAA trong bữa ăn | LAA một lần mỗi ngày (insulin detemir hoặc insulin glargine có thể yêu cầu dùng hai lần mỗi ngày); nói chung là 50% TDD. Giờ ăn và hiệu chỉnh: URAA hoặc RAA dựa trên ICR và/hoặc ISF và glucose mục tiêu. | Có thể sử dụng bút cho tất cả các thành phần. Linh hoạt về thời gian và nội dung bữa ăn. Các chất tương tự insulin ít gây hạ đường huyết hơn insulin ở người. | Ít nhất bốn lần tiêm hàng ngày. Insulins đắt tiền nhất. Lượng insulin tăng nhỏ nhất là 1 đơn vị (0,5 đơn vị với một số bút). LAA có thể không bao gồm hiện tượng bình minh mạnh (tăng glucose vào sáng sớm) cũng như liệu pháp bơm. | Insulin giờ ăn: nếu việc đếm carbohydrate là chính xác, hãy thay đổi ICR nếu glucose sau bữa ăn luôn nằm ngoài mục tiêu. Insulin hiệu chỉnh: điều chỉnh ISF và/hoặc đường đích nếu việc hiệu chỉnh không đưa đường huyết vào phạm vi một cách nhất quán. LAA: dựa trên lượng đường qua đêm hoặc lúc đói hoặc đường ban ngày ngoài thời gian hoạt động, hoặc tiêm URAA hoặc RAA. |
Các phác đồ tiêm insulin nhiều mũi kém linh hoạt hơn trong điều trị đái tháo đường type 1
| Phác đồ | Thời gian và phân phối | Thuận lợi | Nhược điểm | Điều chỉnh liều lượng |
|---|---|---|---|---|
| Bốn lần tiêm mỗi ngày với liều cố định N và RAA | Trước bữa sáng: RAA ∼20% TDD. Trước bữa trưa: RAA ∼10% TDD. Trước bữa tối: RAA ∼10% TDD. Giờ đi ngủ: N ∼50% TDD. | Có thể khả thi nếu không thể đếm carbohydrate. Tất cả các bữa ăn đều có bảo hiểm RAA. N rẻ hơn LAA. | RAA thời gian ngắn hơn có thể dẫn đến thâm hụt cơ bản trong ngày; có thể cần N. hai lần mỗi ngày. Nguy cơ hạ đường huyết về đêm cao hơn N. Yêu cầu thời gian ăn và lượng carbohydrate tương đối nhất quán. | RAA trước bữa sáng: dựa trên nền tảng BGM sau bữa sáng hoặc trước bữa trưa. RAA trước bữa trưa: dựa trên BGM sau bữa trưa hoặc trước bữa tối. RAA trước bữa tối: dựa trên BGM sau bữa tối hoặc trước khi đi ngủ. Buổi tối N: dựa trên BGM nhịn ăn hoặc qua đêm. |
| Bốn lần tiêm mỗi ngày với liều cố định N và R | Bữa sáng trước: R ∼20% TDD. Trước bữa trưa: R ∼10% TDD. Trước bữa tối: R ∼10% TDD. Giờ đi ngủ: N ∼50% TDD. | Có thể khả thi nếu không thể đếm carbohydrate. R có thể được định lượng dựa trên ICR và hiệu chỉnh. Tất cả các bữa ăn đều có R. Ít chất độn đắt tiền nhất. | Nguy cơ cao hơn bị hạ đường huyết về đêm với N. Nguy cơ cao hơn bị hạ đường huyết muộn sau bữa ăn với R. Yêu cầu thời gian ăn và lượng carbohydrate tương đối nhất quán. R phải được tiêm trước bữa ăn ít nhất 30 phút để có hiệu quả tốt hơn. | Trước bữa sáng R: dựa trên nhạc nền sau bữa sáng hoặc trước bữa trưa. Trước bữa trưa R: dựa trên BGM sau bữa trưa hoặc trước bữa tối. Trước bữa tối R: dựa trên nhạc nền sau bữa tối hoặc trước khi đi ngủ. Buổi tối N: dựa trên BGM nhịn ăn hoặc qua đêm. |
Các chế độ với số lần tiêm hàng ngày ít hơn:
| Phác đồ | Thời gian và phân phối | Thuận lợi | Nhược điểm | Điều chỉnh liều lượng |
|---|---|---|---|---|
| Ba lần tiêm mỗi ngày: N + R hoặc N + RAA | Trước bữa sáng: ∼40% N + ∼15% R hoặc RAA. Trước bữa tối: ∼15% R hoặc RAA. Giờ đi ngủ: 30% N. | Có thể trộn insulin buổi sáng trong một ống tiêm. Có thể thích hợp cho những người không thể tiêm thuốc vào giữa ngày. Buổi sáng N bao gồm bữa trưa ở một mức độ nào đó. Cùng ưu điểm của RAA so với R. Insulins ít hơn (N + R) hoặc rẻ hơn so với MDI với các chất tương tự. | Nguy cơ hạ đường huyết về đêm với N cao hơn LAA. Nguy cơ hạ đường huyết chậm sau bữa ăn với R cao hơn so với RAA. Yêu cầu thời gian ăn và lượng carbohydrate tương đối nhất quán. Lượng đường bao phủ sau bữa ăn trưa thường không tối ưu. R phải được tiêm trước bữa ăn ít nhất 30 phút để có hiệu quả tốt hơn. | Buổi sáng N: dựa trên BGM trước bữa tối. Buổi sáng R: dựa trên BGM trước bữa trưa. RAA buổi sáng: dựa trên BGM sau bữa sáng hoặc trước bữa trưa. Trước bữa tối R: dựa trên nhạc nền trước khi đi ngủ. RAA trước bữa tối: dựa trên BGM sau bữa tối hoặc trước khi đi ngủ. Buổi tối N: dựa trên BGM lúc đói. |
| Hai lần mỗi ngày “hỗn hợp chia nhỏ”: N + R hoặc N + RAA | Trước bữa sáng: ∼40% N + ∼15% R hoặc RAA. Trước bữa tối: ∼30% N + ∼15% R hoặc RAA. | Số lần tiêm ít nhất đối với những người có sở thích cao về việc này. Insulin có thể được trộn trong một ống tiêm. Chất cách điện đắt tiền nhất (N + R) hoặc ít hơn (N + RAA) so với chất tương tự. Loại bỏ nhu cầu về liều trong ngày. | Nguy cơ hạ đường huyết vào buổi chiều hoặc giữa đêm từ N. Giờ ăn và nội dung bữa ăn cố định. Lượng đường bao phủ sau bữa ăn trưa thường không tối ưu. Khó đạt được mục tiêu về đường huyết nếu không hạ đường huyết. | Buổi sáng N: dựa trên BGM trước bữa tối. Buổi sáng R: dựa trên BGM trước bữa trưa. RAA buổi sáng: dựa trên BGM sau bữa sáng hoặc trước bữa trưa. Buổi tối R: dựa trên nhạc nền trước khi đi ngủ. RAA buổi tối: dựa trên BGM sau bữa tối hoặc trước khi đi ngủ. Buổi tối N: dựa trên BGM lúc đói. |
Phương pháp điều trị bằng noninsulin cho bệnh đái tháo đường type 1
Thuốc hạ đường huyết dạng tiêm và đường uống đã được nghiên cứu về hiệu quả hỗ trợ điều trị bệnh đái tháo đường type 1 bằng insulin. Pramlintide dựa trên peptide amylin tế bào beta tự nhiên và được chấp thuận sử dụng cho người lớn mắc bệnh đái tháo đường type 1.
Các thử nghiệm lâm sàng đã chứng minh giảm A1C (0,3–0,4%) và giảm cân nhẹ (~1kg) với pramlintide (30–33). Tương tự, kết quả đã được báo cáo cho một số thuốc hiện chỉ được chấp thuận để điều trị bệnh đái tháo đường type 2.
Việc bổ sung metformin ở người lớn mắc bệnh đái tháo đường type 1 làm giảm nhẹ trọng lượng cơ thể và mức lipid nhưng không cải thiện A1C (34,35). Các thử nghiệm lâm sàng lớn nhất về chất chủ vận thụ thể peptide 1 giống glucagon (GLP-1 RAs) ở bệnh đái tháo đường type 1 đã được tiến hành với liraglutide 1,8 mg mỗi ngày, cho thấy mức giảm A1C khiêm tốn (0,4%), giảm trọng lượng (5 kg) và giảm liều lượng insulin (36,37).
Tương tự, các chất ức chế natri – glucose cotransporter 2 (SGLT2i) đã được nghiên cứu trong các thử nghiệm lâm sàng ở những người mắc bệnh đái tháo đường type 1, cho thấy cải thiện A1C, giảm trọng lượng cơ thể và cải thiện huyết áp (38–40); tuy nhiên, việc sử dụng chất ức chế SGLT2i ở bệnh đái tháo đường type 1 có liên quan đến việc tăng tỷ lệ nhiễm toan ceton do đái tháo đường.
Các nguy cơ và lợi ích của các tác nhân bổ trợ tiếp tục được đánh giá, với các tuyên bố đồng thuận cung cấp hướng dẫn về lựa chọn bệnh nhân và các biện pháp phòng ngừa (41); chỉ pramlintide được chấp thuận để điều trị bệnh đái tháo đường type 1.
PHẪU THUẬT ĐIỀU TRỊ ĐÁI THÁO ĐƯỜNG TYPE 1
Cấy ghép tụy và tế bào đảo tuyến tụy
Việc cấy ghép tuyến tụy và tế bào đảo thành công có thể bình thường hóa mức đường huyết và giảm thiểu các biến chứng mạch máu nhỏ của bệnh đái tháo đường type 1.
Tuy nhiên, những bệnh nhân được điều trị bằng phương pháp này cần sử dụng thuốc ức chế miễn dịch suốt đời để ngăn ngừa thải ghép và/hoặc tái phát hủy hoại tế bào đảo tự miễn. Do tác dụng phụ tiềm ẩn của liệu pháp ức chế miễn dịch, nên chỉ định ghép tụy cho bệnh nhân đái tháo đường týp 1 đang ghép thận đồng thời, sau ghép thận, hoặc cho những người bị nhiễm toan ceton tái phát hoặc hạ đường huyết nghiêm trọng mặc dù đã quản lý đường huyết tích cực (42).
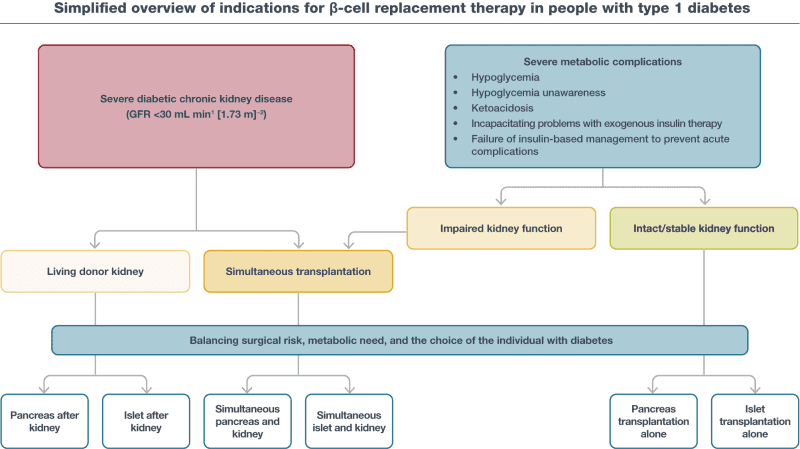
Báo cáo đồng thuận của ADA/EASD năm 2021 về quản lý bệnh đái tháo đường type 1 ở người trưởng thành cung cấp một cái nhìn tổng quan đơn giản về các chỉ định điều trị thay thế tế bào beta ở những người mắc bệnh đái tháo đường type 1 (Hình 9.2) (5).
Bài viết được dịch từ Pharmacologic Approaches to Glycemic Treatment: Standards of Medical Care in Diabetes—2022
Share bài viết:
THẢO LUẬN – HỎI ĐÁP
Nếu bạn có comment hay câu hỏi nào, vui lòng đến trang HỎI ĐÁP BỆNH TIỂU ĐƯỜNG để thảo luận.